【获奖论文】降钙素基因相关肽对骨质疏松性骨折愈合影响的体外研究
发布时间:2017-11-23文章来源:中华骨科杂志, 2017,37(06) : 353-359|||作者:梁伟 吕天成 李理 李兵
摘要
目的
探讨降钙素相关基因肽(calcitonin gene-related peptide,CGRP)对骨质疏松大鼠的骨髓基质干细胞(bone mesenchymal stem cells,BMSCs)成骨分化能力及其血管内皮细胞(vascular endothelial cells,VECs)增殖的影响,及其促进骨质疏松性骨折愈合的细胞分子学作用机制。
方法
取3月龄SD大鼠10只,予双侧卵巢切除术制作骨质疏松模型,术后6个月予显微CT(Micro-CT)行骨密度检测,确定建模成功;后采用全血贴壁法分离骨质疏松性大鼠的BMSCs及VECs;在细胞培养液中加入不同浓度(1×10-7~1×10-10 mol/L)的CGRP,采用细胞增殖检测(CCK-8)法检测细胞增殖能力;CGRP对骨质疏松大鼠BMSCs成骨分化能力的影响:通过碱性磷酸酶活性检测及逆转录-聚合酶链反应(RT-PCR)方法检测碱性磷酸酶、Ⅰ型胶原、重组人骨形态发生蛋白2、骨黏连蛋白、RunX2蛋白等成骨相关细胞基因mRNA的表达。CGRP对骨质疏松大鼠VECs血管化的影响:采用ELISA、RT-PCR法分别检测细胞内皮细胞生长因子(vascular cell endothelial growth factor,VEGF)的蛋白分泌和基因表达水平。
结果
成功分离培养出骨质疏松大鼠BMSCs;CCK-8法测定细胞增殖能力,CGRP对BMSCs细胞的影响:CGRP各浓度组较对照组均增加,且呈剂量依赖关系,7 d时对照组OD值为0.58±0.02,CGRP组中10-7~10-10 mol/L分别为0.80±0.03,0.79±0.03,0.74±0.03,0.69±0.03,与对照组的差异均有统计学意义;CGRP对VECs细胞的影响:对照组OD值为2.20±0.01,CGRP组中10-7~10-10 mol/L分别为4.12±0.04,3.90±0.02,3.56±0.04,3.12±0.04,与对照组的差异均有统计学意义。碱性磷酸酶活性检测及RT-PCR方法检测碱性磷酸酶、Ⅰ型胶原、重组人骨形态发生蛋白2、骨黏连蛋白、RunX2蛋白等成骨相关细胞基因mRNA的表达,对照组与CGRP应用的各浓度组的差异均有统计学意义。
结论
10-7~10-10 mol/L的CGRP可以促进骨质疏松大鼠BMSCs及VECs增殖,且呈浓度依赖性,并能促进BMSCs的成骨分化、细胞VEGF基因表达及蛋白的分泌、血管生成。
骨质疏松症是一种常见的骨科代谢性疾病,由骨质疏松引发的骨折发病率逐年增高。骨质疏松性骨折多发生于老年人,属于病理性骨折,因骨质量差,骨折初始固定不牢固、稳定性差、骨折愈合过程缓慢、恢复时间长,易发生骨折延迟愈合甚至不愈合等系列问题,针对骨质疏松性骨折原因及愈合的相关研究已成为热点[1]。成骨细胞的增殖及分化和骨折局部血管化是促进骨质疏松性骨折愈合的关键因素,而骨髓基质干细胞(bone mesenchymal stem cells,BMSCs)在特异因子诱导下,具有向多种细胞系分化的潜能,可分化为骨细胞、软骨细胞、心肌细胞、血管内皮细胞、神经元样细胞、脂肪细胞、胰岛β细胞等。如BMSCs成脂分化能力增强而成骨分化能力降低,可致骨质疏松,表现为骨量减少与髓腔内的脂肪增多[2]。如何使BMSCs成骨分化能力增强,成为骨质疏松性骨折的研究方向。
近年来,神经系统对骨组织代谢的作用的相关研究受到越来越多的重视,神经纤维末梢可以通过释放多种神经递质分子如钙素相关基因肽(calcitonin gene-related peptide,CGRP)、神经肽、P物质等发挥作用。在骨组织周围分布着大量CGRP阳性神经纤维,这些神经纤维可分泌CGRP调节细胞功能,并增加骨折局部供血。CGRP表达强度提高,有利于刺激骨折愈合过程中各种细胞的迁移、增殖及分化,形成大量的骨性骨痂和软骨痂[4]。另外,CGRP参与调节骨折局部的多种细胞功能,对骨折愈合过程中骨痂的血管生成也有促进作用,可刺激骨折微环境下血管内皮细胞(vascular endothelial cells,VECs)增殖,加速血管生成,增加局部血流;同时促进骨折愈合过程中BMSCs增殖,刺激细胞内成骨相关基因的表达,增加碱性磷酸酶(alkaline phosphatase,ALP)的活性,促进细胞向成骨细胞分化及矿化,刺激骨痂的生长[3,4]。但CGRP能否加速骨质疏松骨折的病理环境下的血管化,并促进BMSCs增殖及分化仍然需要进一步研究。
本研究使用卵巢切除法制造骨质疏松大鼠模型,提取BMSCs及VECs,在体外与不同浓度CGRP共培养,观察CGRP对骨质疏松大鼠BMSCs及VECs细胞的影响,目的在于:①明确CGRP是否可对病理性BMSCs的增殖及成骨分化及VECs的成血管化起到促进作用;②初步探讨CGRP促进骨质疏松性骨折愈合的细胞分子作用机制。
材料与方法
一、建立骨质疏松动物模型
取10只3月龄雌性SD大鼠(广西医科大学实验动物中心提供),体重220~260 g,随机分为两组:双侧卵巢切除术组(ovariectomy组,ovx组)5只,采用双侧卵巢切除术建立骨质疏松模型;假手术组(sham operation组,sham组)5只,仅切除少许脂肪组织。
术后6个月行显微CT(Micro-CT)扫描检测股骨相对骨体积(bone volume/tissue volume,BV/TV)和骨密度(bone mineral density,BMD)确认骨质疏松模型是否建立成功。
二、材料和试剂
本研究中采用α-杜尔伯科改良伊格尔培养液(α-DMEN,#11320-033,Gibco公司,美国),胎牛血清(FBS,#16000-044,Gibco公司,美国),DMEM/F12培养液(# 11330057,Gibco公司,美国),细胞培养板(Coming公司,美国),CCK-8(#PA5-32348,Life technologies公司,美国),ALP染色试剂盒(#AP0100-1KT,Sigma公司,美国),TRIzol试剂盒(#15596-066,Invitrogen公司,美国),CGRP(#C2806,Sigma公司,美国),VEGF ELISA试剂盒(#ERVEGFACL,Gibco公司,美国)。
三、分离提取BMSCs
取骨质疏松动物模型,分离双侧股骨及胫骨,去除周围软组织,两端开槽后用α-DMEN培养液冲洗骨髓腔数次,1 600 r/min离心6 min后弃上清,用含体积分数10%胎牛血清的α-DMEN培养基(含1%青霉素和链霉素)重悬细胞,接种于25 cm培养瓶内,37 ℃、体积分数为5%的CO2条件下孵育,隔天换液体积分数为0.25%胰蛋白酶消化传代至第三代为实验用细胞。
四、VECs的分离与培养
取骨质疏松动物模型,无菌条件下开胸取出胸主动脉及周围软组织,暴露主动脉内膜,结扎动脉两端后用烧热的镊子烫烙,置于50 ml铺有鼠尾胶培养瓶中培养,采用含体积分数20%胎牛血清的DMEM/F12培养液培养,6 d后换液并弃置主动脉,观察细胞铺满瓶底80%时候,体积分数0.25%胰蛋白酶消化传代。
五、CCK-8检测细胞增殖
培养基稀释BMSCs及VECs,并以1×104个/孔接种于96孔细胞培养板,24 h后换入不同浓度CGRP的培养液200 μl,设立不含CGRP培养液为对照组。采用CCK-8法在波长450 nm下检测第1、3、5、7天的光密度值以了解细胞的增殖情况。每组重复5个样本。
六、BMSCs的成骨分化
(一)ALP活性
将BMSCs以2×104/孔接种于24孔细胞培养板,24 h后换入单纯培养液及含不同浓度CGRP的培养液。使用ALP试剂盒法检测第1、3、7、14天的ALP活性表达。每组重复5个样本。
(二)BMSCs成骨相关基因检测
使用TRIzol试剂盒提取细胞的RNA,常规行反转录酶-聚合酶链锁反应(RT-PCR)实验,检测第1、3、7、14天细胞成骨基因的表达情况。
ALP引物:上游5’-CGTTGACTGTGGTTACTGCTGA-3’,下游5’-TTGTAACCAGGCCCGTTG-3’;BMP-2引物:上游5’-CGTGCTCAGCTTCCATCAC-3’,下游5’-CCTGCATTTGTTCCCGAAA-3’。
RunX2引物:上游5’-TTTGCAGTGGGACCGACA-3’,下游5’-AGCCATGGTGCCCGTTAG-3’。
Ⅰ型胶原蛋白引物:上游5’-TCTCCATGGCCTCTGCAA-3’,下游5’-CATGTGTGGCCGATGTTTC-3’。
骨黏连蛋白引物:上游5’-CTCCCATTGGCGAGTTTG-3’,下游为5’-TGTAGTCCAGGTGGAGCTTGTG-3’。
内参选用甘油醛-3-磷酸脱氢酶(GAPDH)引物:上游5’-CACAGTCAAGGCTGAGAATG-3’,下游5’-GGTGGTGAAGACGCCAGTA-3’。每组测试5个平行样本。
七、VECs的血管内皮因子的分泌
(一)ELISA法检测细胞分泌血管内皮因子水平
第三代VECs稀释到2 ml细胞培养液中,添加到12孔细胞培养板,24 h后换入含不同浓度CGRP的培养液作为实验组,并设对照组。继续培养第1、2、3天后分别收集上清液,采用ELISA检测试剂盒方法进行检测血管内皮细胞生长因子(vascular cell endothelial growth factor,VEGF)水平。每组设5个平行样本,比较各组细胞分泌VEGF水平。
(二)PCR法检测VECs中VEGF的表达水平
骨质疏松大鼠VECs在CGRP实验组及sham组中培养1、2、3 d后,用TRIzol法收集各组细胞的RNA,用光谱仪检测其纯度和浓度。
设计合成RNA引物:VEGF引物:上游5’-ACTCGCCCTCATCCTCTTCC-3’,下游5’-TCAACACACTCACACACACAAC-3’;内参选用β-Actin引物:上游5’-TGGCACCCAGCACAATGAA -3’,下游5’-CTAAGTCATAGTCCGCCTAGAA GCA-3’。
使用TRIzol法进行总RNA抽提,反转录为cDNA,PCR反应条件优化,随后采用SYBR GreenⅠ染料法进行RT-PCR检测,按照试剂盒说明书配好反应体系,上机进行扩增和检测。循环结束后进行融解曲线绘制。每组测试5个平行样本。
八、统计学分析
采用SPSS 19.0(SPSS公司,美国)统计学软件包进行统计学处理。计数资料采用均数±标准差(±s)的形式表示,CGRP实验组(10-7~10-10 mol/L)与对照组的ELISA及PCR数据的比较采用Students’成组设计资料t检验,检验水准α值取双侧0.05。
结果
一、骨质疏松大鼠模型
经Micro-CT分析结果显示术后6个月sham组BV/TV为17.1%±2.5%,ovx组为3.4%±0.9%,sham组较ovx组多13.7%,差异有统计学意义;sham组BMD为(0.343±0.030)g/cm2,ovx组(0.183±0.019)g/cm2,sham组较ovx组多0.12 g/cm2,差异有统计学意义。
二、CCK-8法检测细胞增殖
细胞培养1 d后各实验组及对照组之间无明显差异,在第3、5、7天,CGRP各组细胞较对照组均显著增加,差异均有统计学意义。
7 d后对照组OD值0.58±0.02,CGRP组中10-7~10-10 mol/L各组分别为0.80±0.03,0.79±0.03,0.74±0.03,0.69±0.03,各组与对照组比较,差异均有统计学意义。10-7mol/L组的BMSCs增值率为较对照组提高了约30%,在实验组各个浓度CGRP的组内比较发现,10-7 mol/L组增殖最快,这说明细胞增殖与CGRP的浓度在10-7~10-10 mol/L之间呈剂量依赖型(图1A)。
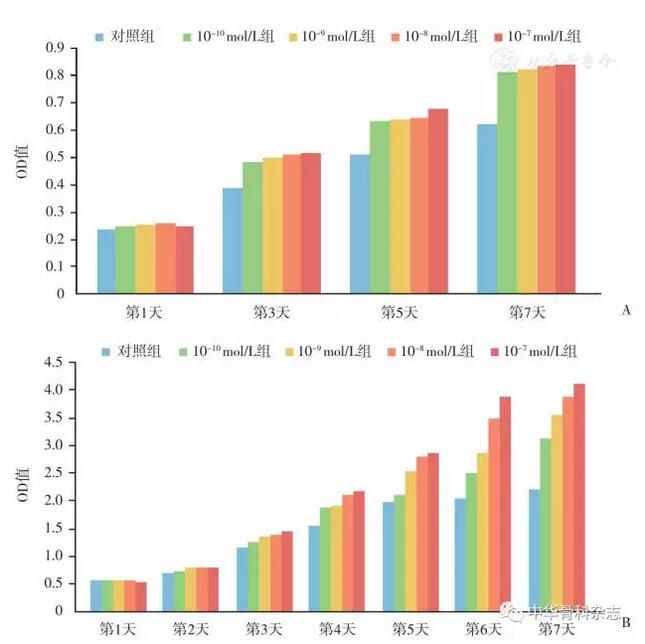
图1 细胞增殖实验结果 A CGRP对BMSCs细胞增殖的影响,采用CCK-8法检测,不同浓度的CGRP(10-10~10-7mol/L)均可促进细胞增殖,且呈浓度依赖性 B CGRP对VECs细胞增殖的影响,不同浓度的CGRP均可促进细胞增殖,且呈浓度依赖性
CGRP对VECs细胞增殖的影响检测发现:对照组OD值2.20±0.01,CGRP浓度10-7~10-10 mol/L各组分别为4.12±0.04,3.90±0.024,3.56±0.04,3.12±0.04,各组与对照组的差异均具有统计学意义(图1B)。
三、CGRP对BMSCs细胞成骨分化的影响
7 d后ALP对照组为1.000±0.205,CGRP浓度10-7 mol/L组为2.578±0.210,CGRP浓度10-10 mol/L组为2.351±0.201;BMP-2对照组为0.980±0.200,CGRP浓度10-7 mol/L组为3.428±0.255,CGRP浓度10-10 mol/L组为2.915±0.202;COLL-Ⅰ对照组为1.030±0.202,CGRP浓度10-7 mol/L组为2.519±0.240,CGRP浓度10-10 mol/L组为2.348±0.201;RunX2对照组为0.993±0.213,CGRP浓度10-7 mol/L组为2.499±0.262,CGRP浓度10-10 mol/L组为2.220±0.250;骨黏连蛋白对照组为1.020±0.200,CGRP浓度10-7 mol/L组为1.973±0.212,10-10 mol/L组为1.864±0.250,各组与对照组的差异有统计学意义。
14 d后ALP对照组为0.005±0.000,CGRP浓度10-7~10-10 mol/L组分别为0.044±0.002,0.042±0.003,0.039±0.001,0.025±0.001,各组与对照组比较的差异有统计学意义。
细胞ALP活性检测结果显示:CGRP作用于细胞7、14 d,含不同浓度CGRP的实验组较对照组ALP活性增加,差异有统计学意义,7 d时10-7 mol/L组的碱性磷酸酶活性较对照组提高了约一倍,提示CGRP早期可以促进BMSCs成骨分化(图2)。PCR基因检测结果显示CGRP能增加成骨分化的早期ALP和COLL-Ⅰ基因的表达,同时促进成骨分化晚期BMP-2,骨黏连蛋白和RunX2基因的表达(图3)。
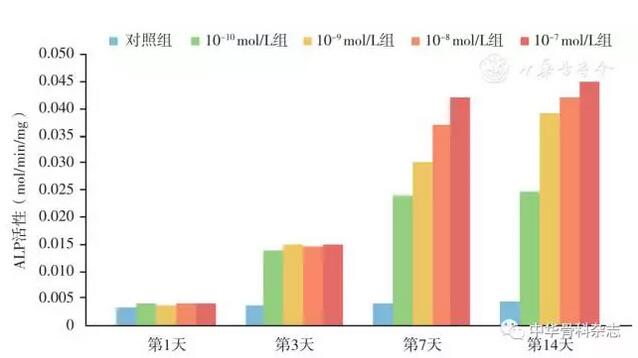
图2 CGRP对BMSCs细胞分泌ALP活性检测,随时间增加,不同浓度CGRP(10-10~10-7 mol/L)均可促进细胞分泌ALP,且呈浓度依赖性
图3 成骨相关基因的PCR检测结果 A 随着时间推移,CGRP上调ALP的表达,且10-10 mol/L组的表达水平高于10-7 mol/L组 B 随着时间推移,CGRP上调BMP-2的表达,且10-10 mol/L组的表达水平高于10-7 mol/L组 C 随着时间推移,CGRP上调COLL-Ⅰ的表达,且CGRP浓度10-10 mol/L组的表达水平高于10-7mol/L组 D 随着时间推移,CGRP上调骨黏连蛋白的表达,且10-10 mol/L组的表达水平高于10-7 mol/L组 E 随着时间推移,CGRP上调RunX2的表达,且10-10 mol/L组的表达水平高于10-7 mol/L组
四、CGRP对VECs的VEGF的分泌的影响
采用VEGF-ELISA试剂盒检测细胞受CGRP刺激培养1、3、5、7 d后培养液中细胞分泌VEGF水平,7 d后对照组VEGF浓度为3.218±0.314,CGRP浓度10-7~10-10 mol/L分别为5.579±0.564,4.792±0.159,4.721±0.358,4.675±0.112,各组与对照组的差异均有统计学意义。含不同浓度CGRP的实验组的VEGF水平均明显高于对照组,由此说明释放CGRP促进VECs分泌VEGF(图4)。
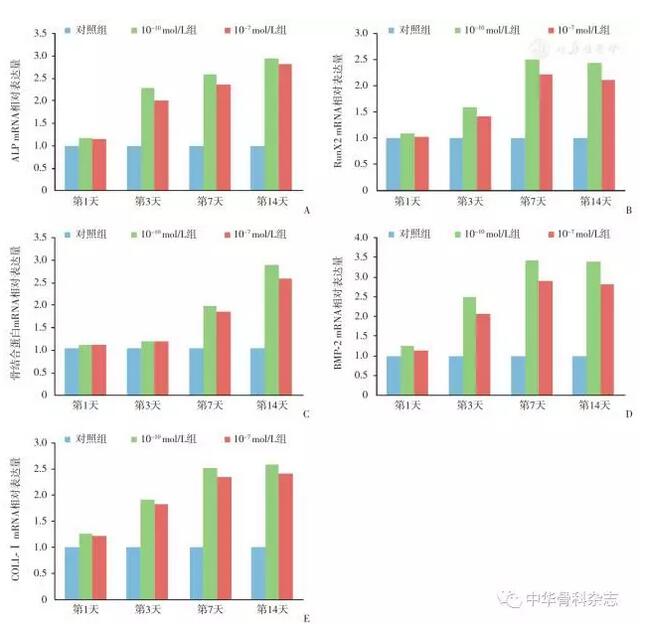
图4 CGRP对血管内皮细胞分泌VEGF的结果,通过ELISA法检测发现,随着时间的增加,不同浓度的CGRP(10-10~10-7mol/L)均可刺激细胞分泌VEGF,且呈浓度依赖性
PCR检测细胞中VEGF基因表达水平:7 d后对照组VEGF浓度0.999±0.008,CGRP浓度10-7 mol/L为4.433±0.182,10-10 mol/L为4.121±0.195,各组与对照组的差异均有统计学意义。各时间点CGRP实验组VEGF-mRNA的表达水平均较对照组增高,结果与ELISA检测结果相同。无论是VEGF基因表达水平,还是蛋白分泌水平,CGRP实验组均明显高于对照组(图4,图5)。
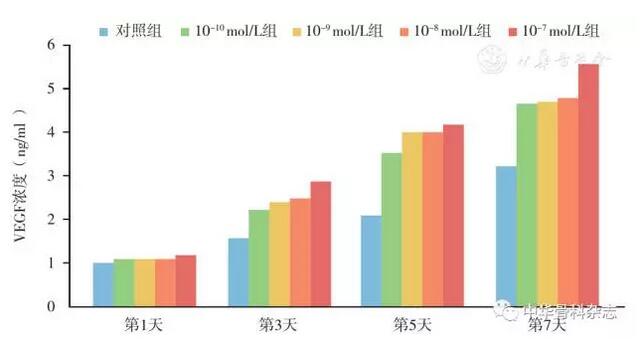
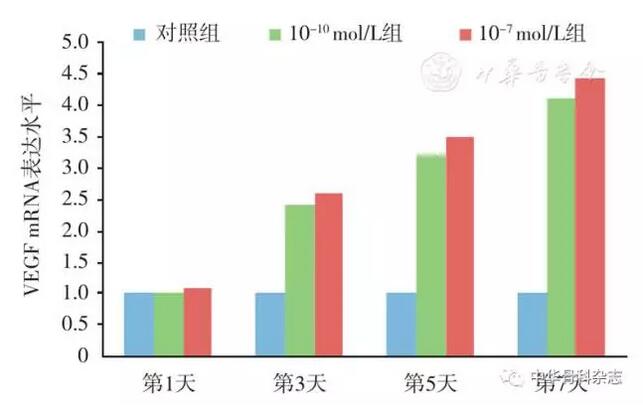
图5 VEGF mRNA的表达,通过RT-PCR检测发现CGRP可上调细胞中VEGF mRNA的表达,且10-7 mol/L的表达量最高
讨论
一、骨质疏松性骨折的特点
骨组织是一种复杂的动态组织,在其不断的新陈代谢过程中,成骨细胞与破骨细胞是最关键的两种细胞,它们的共同作用调节骨组织代谢。骨组织周围还伴行着大量的血管及神经。因此,骨组织的修复过程,其实是神经对骨组织的调控下及血管对骨组织的能量供应的前提下,机体各类细胞之间错综复杂的作用。由此可见,血液的供应和神经支配的重建是促进骨折愈合、保持骨折局部修复区域内环境的生物学稳定性关键因素之一。而由骨质疏松症造成的骨折、骨不愈合等一直是威胁人类生命健康的医学难题。骨质疏松骨微环境下,成骨细胞的功能减弱,而过渡活跃的破骨细胞抑制了成骨细胞的活力。同时,骨髓基质干细胞成脂分化能力增强而成骨分化能力减弱,最终导致骨形成减少。
二、CGRP对骨折愈合的作用
CGRP代表一类具有多功能的神经肽,其由37个氨基酸组成的多肽,并由上级神经调控,在脊髓后根神经节神经元内合成,通过轴浆运输的方式到达感觉神经纤维的末梢,以分泌颗粒的形式储存在胞浆中,随着神经末梢分布于周围器官[5,6]。在血管内皮细胞、骨髓基质干细胞、成骨细胞、破骨细胞等这些与骨组织代谢直接相关的细胞表面均存在CGRP受体[7]。CGRP能与这些细胞表面的CGRP受体特异性的结合,发挥作用。在骨折局部环境中新生成的骨组织及骨膜组织上CGRP的阳性纤维大量增加,导致血浆CGRP浓度明显增加[8,9]。神经系统可通过分泌CGRP来参与调节骨折局部的细胞功能,包括增加骨折局部供血;促进BMSCs及成骨细胞增殖及分化来增强骨修复效果[10,11,12,13,14]。
三、CGRP对骨质疏松性骨折愈合的作用
目前研究CGRP对骨组织的影响大多是基于健康细胞株,对于骨质疏松性环境下的研究甚少。本研究成功分离提取骨质疏松大鼠的BMSCs及VECs,体外用CGRP刺激细胞,从细胞的增殖,细胞外基质的改变及细胞内基因的变化来分析其对细胞的作用。CGRP早期能促进BMSCs的增殖,后期能刺激BMSCs分泌ALP,促使细胞向成骨分化。因此,考虑CGRP对BMSCs细胞成骨分化过程中的各个阶段均有作用。CGRP促进BMSCs细胞的增殖,以产生足够多的前体细胞,然后其在后期逐渐刺激细胞向成骨细胞分化。然而CGRP在细胞成骨分化过程中的作用机制仍然不是很清楚。本研究从细胞内基因的层面,探讨CGRP对细胞的作用机制。目前已有许多研究者对BMSCs的成骨分化过程中的相关基因表达进行研究[7],发现ALP、COLL-Ⅰ、骨钙素、骨黏连蛋白、BMP等为较关键的基因。本研究中,使用RT-PCR检测CGRP诱导细胞内BMP-2、RunX2、COLL-Ⅰ、ALP及骨黏连蛋白的mRNA表达,发现CGRP可刺激细胞上述基因及蛋白的表达,且差异有统计学意义。因此,CGRP可激活细胞内BMP-2信号通路途径,上调RUNX2基因的表达,RunX2随后启动成骨细胞特异性基因的表达,如ALP、COLL-2等,促进细胞外基质逐渐成熟使BMSCs向成骨细胞分化。而CGRP也能刺激细胞内VEGF基因的表达,提高细胞分泌VEGF,进而促进细胞的增殖,形成新生血管。
综上所述,本实验分离培养出骨质疏松大鼠BMSCs及VECs,并证实CGRP能刺激血管内皮细胞的增殖和血管生成,改善骨组织中的神经血管微环境,并提高病理性BMSCs增殖的同时促进其向成骨细胞分化,为血供环境差及成骨能力弱的骨质疏性骨损伤的治疗提供一定的理论基础,将CGRP应用于骨折修复可能是骨组织工程治疗骨质疏松性骨折一个新的方向。但骨折愈合涉及多种因素,CGRP应用于临床治疗前还需做更多、更深入的体外细胞实验和动物实验以验证其可行性及安全性。

